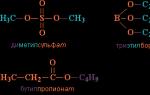
"Ароматические углеводороды (арены). Бензол. Строение молекулы". Строение бензола. Ароматичность Электронное и пространственное строение молекулы бензола
ОПРЕДЕЛЕНИЕ
Ароматические углеводороды (арены) - вещества, в молекулах которых содержится одно или несколько бензольных колец.
Общая формула гомологического ряда бензола C n H 2 n -6 . Простейшими представителями ароматических углеводородов являются бензол - C 6 H 6 и толуол - C 6 H 5 -CH 3 . Углеводородные радикалы, полученные из аренов носят названия: C 6 H 5 - — фенил (Ph-) и C 6 H 5 -CH 2 — — бензил.
Первые члены гомологического ряда бензола - бесцветные жидкости со специфическим запахом. Они легче водды и в ней практически нерастворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями.
Электронное строение бензолов
Рассмотрим строение ароматических углеводородов на примере молекулы бензола. Это химическое соединение впервые было выделено из продуктов переработки каменного угля в 1825 году, однако, для того, чтобы установить строение его молекулы потребовалось три десятилетия. В 1865 году немец Ф. А. Кекуле высказал идею о том, что атомы углерода в бензоле соединены не в виде открытой цепи, а замкнуты в цикл (рис. 1). По его представлениям молекула бензола - это замкнутый цикл, состоящий из шести атомов углерода с тремя чередующимися двойными связями. Однако Кекуле так и не смог объяснить ряд особых свойств, присущих бензолу: почему бензол не проявляет склонность к реакциям присоединения (не обесцвечивает бромную воду и перманганат калия) несмотря на наличие двойных связей и т.д.
Рис. 1. Строение молекулы бензола по Кекуле.
Согласно представлениям современной органической химии, молекула бензола является правильным плоским шестиугольником. Все шесть атомов углерода находятся в sp 2 -гибридном состоянии. Каждый атом углерода образует σ - связи с двумя атомами углерода и одним атомом водорода, лежащими в плоскости цикла. Валентные углы между тремя σ - связями равны 120 o .
Каждый атом углерода в молекуле бензола имеет одну негибридизованнуюp - орбиталь. Шесть этих орбиталей располагаются перпендикулярно плоскому σ - скелету и параллельно друг другу. При их взаимном перекрывании образуется единое π-электронное облако, т.е. осуществляется круговая делокализация электронов. Наибольшая π-электронная плотность в этой сопряженной системе располагается над плоскостью σ - скелета молекулы и охватывает все шесть атомов углеродного цикла. В результате все связи между атомами углерода в бензоле выравнены и имеют длину 0,139 нм (рис. 2).

Рис. 2. Строение молекулы бензола.
Совокупность свойств бензола называют проявлением ароматического характера, или ароматичности. Явление ароматичности подчиняется правилу Хюккеля, согласно которому ароматические молекулы должны иметь плоский циклический σ - скелет и число обобщенных π-электронов, равное (4n+2), где n = 0, 1, 2, 3 и т.д.
Примеры решения задач
ПРИМЕР 1
| Задание | Плотность паров вещества 3,482 г/л. Его пиролиз дал 6 г сажи и 5,6 л водорода. Определите формулу этого вещества. |
| Решение | Сажа представляет собой углерод. Найдем количество вещества сажи исходя из условий задачи (молярная масса углерода равна 12 г/моль):
n(C) = m(C) / M(C); n(C) = 6 / 12 = 0,5 моль. Рассчитаем количество вещества водорода: n(H 2) = V(H 2) / V m ; n(H 2) = 5,6 / 22,4 = 0,25 моль. Значит, количество вещества одного атома водорода будет равно: n(H) = 2 × 0,25 = 0,5 моль. Обозначим количество атомов углерода в молекуле углеводорода за «х», а количество атомов водорода за «у», тогда соотношение этих атомов в молекуле: х: у = 0,5: 0,5 =1:1. Тогда простейшая формула углеводорода будет выражаться составом СН. Молекулярная масса молекулы состава СН равна: М(СН) = 13 г/моль Найдем молекулярную массу углеводорода исходя из условий задачи: M (C x H y) = ρ×V m ; M (C x H y) = 3,482×22,4 = 78 г/моль. Определим истинную формулу углеводорода: k= M(C x H y)/ М(СН)= 78/13 =6, следовательно, коэффициенты «х» и «у» нужно умножить на 6 и тогда формула углеводорода примет вид C 6 H 6 . Это бензол. |
| Ответ | Искомый углеводород имеет состав C 6 H 6 . Это бензол. |
Ароматические углеводороды (арены)
Представители ароматических углеводородов - бензол С 6 Н 6 и его гомологи -имеют циклическое строение. Οʜᴎ могут иметь насыщенные или ненасыщенные боковые цепи. Некоторые из производных бензола обладают приятным запахом. По этой причине сохранилось их прежнее историческое название - ароматические углеводороды. Сегодня известны многие вещества, которые по строению и химическим свойствам следует отнести к ароматическим углеводородам. Бензол является самым типичным представителем ароматических углеводородов, в молекуле которого шесть атомов углерода.
Экспериментальные данные показывают, что в молекуле бензола 92,3 % углерода, как и в молекуле ацетилена. Следовательно, простейшая формула бензола должна быть такая же, как у ацетилена, - СН. Но плотность паров бензола по водороду равна 39, а масса его моля - 78 г (2D H = 2‣‣‣39). В случае если формула бензола действительно была бы СН, то масса его моля должна быть 13 г, а не 78 ᴦ. Следовательно, молекула бензола состоит из шести атомов углерода и шести атомов водорода (78: 13 = 6), а его молекулярная формула С 6 Н б.
Эксперименты показали, что при повышенной температуре и в присутствии катализаторов к каждой молекуле бензола присоединяются три молекулы водорода и образуется циклогексан. Этим доказывается, что бензол имеет циклическое строение. При этом эксперименты показали, что все связи в молекуле бензола равноценны.
Согласно современным представлениям, в молекуле бензола у каждого атома углерода одно s- и два р-электронных облака гибридизованы (sp 2 -гибридизация), а одно р-электронное облако негибридизованное. Все три гибридизованных электронных облака, перекрываясь с гибридизованными облаками соседних атомов углерода и s-облаками атомов водорода, образуют три σ-связи, которые находятся в одной плоскости. Негибридизованные р-электронные облака атомов углерода расположены перпендикулярно плоскости направления σ -связей. Эти облака тоже перекрываются друг с другом (рис. 40).
В цикле молекулы бензола нет трех отдельных двойных связей: негибридизованное р-электронное облако первого атома углерода перекрывается с негибридизованными р-электронными облаками второго и шестого атомов углерода, а р-электронное облако второго атома углерода перекрывается с негибридизованными р-электронными облаками первого и третьего атомов углерода
Так как электронная плотность в молекуле бензола распределена равномерно, то правильнее структурную формулу бензола изображать в виде шестиугольника с окружностью внутри. Известно много сходных с бензолом ароматических углеводородов - гомологов бензола. Соединения углерода и водорода, в молекулах которых имеется бензольное кольцо, или ядро, относятся кароматическим углеводородам. Сегодня используют формулу I (Фридриха Кекуле (1829-1896) 1865 ᴦ.) или III. Радикал –С 6 Н 5 принято называть фенилом.
Строение молекулы бензола - понятие и виды. Классификация и особенности категории "Строение молекулы бензола" 2017, 2018.
Ароматические углеводороды составляют важную часть циклического ряда органических соединений. Простейшим представителем таких углеводородов является бензол. Формула этого вещества не только выделила его из ряда остальных углеводородов, но и дала толчок в развитии нового направления органической химии.
Открытие ароматических углеводородов
Ароматические углеводороды были открыты в начале 19 века. В те времена наиболее распространенным топливом для уличного освещения являлся светильный газ. Из его конденсата великий английский физик Майкл Фарадей выделил в 1825 году три грамма маслянистого вещества, подробно описал его свойства и назвал так: карбюрированный водород. В 1834 году немецкий ученый, химик Митчерлих, нагревая бензойную кислоту с известью, получил бензол. Формула, по которой протекала данная реакция, представлена ниже:
C6 H5 COOH + CaO сплавление C6 H6 + CaCO3.
В то время редкую бензойную кислоту получали из смолы бензое, которую могут выделять некоторые тропические растения. В 1845 году новое соединение было обнаружено в каменноугольной смоле, которая являлась вполне доступным сырьем для получения нового вещества в промышленных масштабах. Другим источником бензола является нефть, полученная в некоторых месторождениях. Чтобы обеспечить потребность промышленных предприятий в бензоле, его получают также путем ароматизации некоторых групп ациклических углеводородов нефти.
Современный вариант названия предложил немецких ученый Либих. Корень слова «бензол» следует искать в арабских языках - там оно переводится как «ладан».
Физические свойства бензола
Бензол является бесцветной жидкостью со специфическим запахом. Это вещество кипит при температуре 80,1 о С, отвердевает при 5,5 о С и превращается при этом в белый кристаллический порошок. Бензол практически не проводит тепло и электричество, плохо растворяется в воде и хорошо - в различных маслах. Ароматические свойства бензола отражают суть структуры его внутреннего строения: относительно устойчивое бензольное ядро и неопределенный состав.
Химическая классификация бензола
Бензол и его гомологи - толуол и этилбензол - представляют собой ароматический ряд циклических углеводородов. Строение каждого из этих веществ содержит распространенную структуру, названную бензоловым кольцом. Структура каждого из вышеперечисленных веществ содержит особую циклическую группировку, созданную шестью атомами углерода. Она получила название бензольного ароматического ядра.
История открытия
Установление внутреннего строения бензола растянулось на несколько десятилетий. Основные принципы строения (кольцевая модель) были предложены в 1865 году химиком А. Кекуле. Как рассказывает легенда, немецкий ученый увидел формулу этого элемента во сне. Позднее было предложено упрощенное написание структуры вещества, называемого так: бензол. Формула этого вещества представляет собой шестиугольник. Символы углерода и водорода, которые должны быть расположены в углах шестиугольника, опускаются. Таким образом, получается простой правильный шестиугольник с чередующимися одинарными и двойными линиями на сторонах. Общая формула бензола представлена на рисунке ниже.

Ароматические углеводороды и бензол
Химическая формула этого элемента позволяет утверждать, что для бензола реакции присоединения нехарактерны. Для него, как и для других элементов ароматического ряда, типичны реакции замещения атомов водорода в бензольном кольце.
Реакция сульфирования
При обеспечения взаимодействия концентрированной серной кислоты и бензола, повышая температуру реакции, можно получить бензосульфокислоту и воду. Структурная формула бензола в этой реакции выглядит следующим образом:

Реакция галогенирования
Бром или хром в присутствии катализатора взаимодействует с бензолом. При этом получаются галогенопроизводные. А вот реакция нитрирования проходит с использованием концентрированной азотной кислоты. Конечным итогом реакции является азотистое соединение:

С помощью нитрирования получают известное всем взрывчатое вещество - тротил, или тринитотолуол. Мало кто знает, что в основе тола лежит бензол. Многие другие нитросоединения на основе бензольного кольца также могут быть использованы как взрывчатые вещества
Электронная формула бензола
Стандартная формула бензольного кольца не совсем точно отражает внутренне строение бензола. Согласно ей, бензол должен обладать тремя локализованными п-связями, каждая из которых должна взаимодействовать с двумя атомами углерода. Но, как показывает опыт, бензол не обладает обычными двойными связями. Молекулярная формула бензола позволяет увидеть, что все связи в бензольном кольце равноценны. Каждая из них имеет длину около 0,140 нм, что является промежуточным значением между длиной стандартной простой связи (0,154 нм) и двойной этиленовой связи (0,134 нм). Структурная формула бензола, изображенная с чередованием связей, несовершенна. Более правдоподобна трехмерная модель бензола, которая выглядит так, как показано на картинке ниже.

Каждый из атомов бензольного кольца находится в состоянии sp 2 -гибридизации. Он затрачивает на образование сигма-связей по три валентных электрона. Эти электроны охватывают два соседних атома углевода и один атом водорода. При этом и электроны, и связи С-С, Н-Н находятся в одной плоскости.
Четвертый валентный электрон образует облако в форме объемной восьмерки, расположенное перпендикулярно плоскости бензольного кольца. Каждое такое электронное облако перекрывается над плоскостью бензольного кольца и непосредственно под ней с облаками двух соседних атомов углерода.
Плотность облаков п-электронов этого вещества равномерно распределена между всеми углеродными связями. Таким путем образуется единое кольцевое электронное облако. В общей химии такая структура получила название ароматического электронного секстета.
Равноценность внутренних связей бензола
Именно равноценностью всех граней шестиугольника объясняется выравненность ароматических связей, обуславливающих характерные химические и физические свойства, которыми обладает бензол. Формула равномерного распределения п-электронного облака и равноценность всех его внутренних связей показана ниже.

Как видно, вместо чередующихся одинарных и двойных черт внутреннюю структуру изображают в виде окружности.
Сущность внутренней структуры бензола дает ключ к пониманию внутреннего строения циклических углеводородов и расширяет возможности практического применения этих веществ.
УДК 547
ББК 24.23
Рецензенты: кафедра органической химии Ярославского государственного педагогического университета; В.Н.Казин, канд. хим. наук, доцент кафедры общей и биоорганической химии Ярославского государственного университета.
Колпащикова И.С., Кошкин Л.В., Кофанов Е.Р., Обухова Т.А.
К60 Органическая химия. Часть II. Арены. Галогенпроизводные углеводородов: Учебное пособие / Яросл. гос. техн. ун-т.- Ярославль, 1999.- 70 с.
ISBN 5-230-18418-3
Во второй части пособия рассмотрены основные вопросы строения и реакционной способности, типичные реакции и основные способы получения аренов и галогенпроизводных. По указанным разделам приведены контрольные работы.
Предназначено для студентов-заочников химико-технологических специальностей, а также может быть рекомендовано для студентов дневной формы обучения.
Ил. 8. Табл. 4. Библиограф. 6.
ББК 24.23
ISBN 5-230-18418-3 Ó Ярославский государственный
технический университет
АРЕНЫ
Строение бензола. Ароматичность
К аренам относятся соединения, содержащие, по крайней мере, одну бензольную группировку.
В современной химической литературе понятие “соединение ароматического ряда” означает сходство химических свойств соединения со свойствами бензола и не связаны с запахом соединений.
В соответствии с молекулярной формулой С 6 Н 6 бензол является ненасыщенным соединением и можно ожидать, что для него характерна тенденция вступать в типичные для алкенов реакции присоединения. Однако в условиях, в которых алкен быстро вступает в реакции присоединения, бензол не реагирует или реагирует медленно.
Бензол не вступает в реакции присоединения, в которых разрушилась бы p -электронная система бензольного кольца. Такая устойчивость называется кинетической . Она связана со значительной величиной энергии активации. Вместе с тем бензол достаточно легко вступает в реакции замещения. Образующиеся при этом продукты сохраняют специфическую структуру бензола.
Таблица 1.1. Сравнение химических свойств циклогексена и бензола
Вывод об устойчивости ароматической системы следует из сравнения теплот гидрирования одного моля 1,3,5-циклогексатриена, содержащего три независимые двойные и три простые связи. Можно ожидать, что теплота гидрирования 1,3,5-циклогексатриена будет равна утроенной теплоте гидрирования одного моля циклогексена: 120,4 ´ 3 =361,2 кДж.


Однако экспериментальная теплота гидрирования одного моля бензола составляет 209 кДж, что на 152 кДж меньше. Следовательно, бензол беднее энергией, чем гипотетический 1,3,5-циклогексатриен. Эта энергия называется энергией резонанса . Стабилизация за счет энергии резонанса является причиной термодинамической устойчивости .
В бензоле каждый атом углерода находится в sp 2 -состоянии и связан тремя s -связями с двумя атомами углерода и одним атомом водорода. Атомы углерода и водорода лежат в одной плоскости. Четвертый валентный электрон атома углерода находится на 2p -орбитали, перпендикулярной плоскости молекулы. Эти p -орбитали состоят из двух одинаковых долей, одна из которых лежит выше, другая - ниже плоскости кольца. 2р -орбиталь каждого атома углерода перекрывается с 2р -орбиталями обоих соседних атомов углерода. В результате образуется замкнутая шести-p -электронная система в виде двух бубликов, один из которых лежит выше, а другой ниже плоскости правильного шестиугольника (рис. 1.1а).
Благодаря коллективному взаимодействию всех шести p-электронов происходит выравнивание углерод-углеродных связей по длине и кратности: длина всех связей С-С в бензоле (0,1399 нм) является средней между длиной двойной связи в алкенах (0,134 нм) и расчетным значением длины простой связи =С-C=(0,148 нм) (рис. 1.1б). Вторым следствием коллективного p- электронного взаимодействия является электронная и связанная с ней термодинамическая и кинетическая стабилизация.

Рис. 1.1.Молекула бензола:
а - перекрывание 2р-орбиталей, образующих p- связи;
б - длины связей и валентные углы в молекуле бензола
Какие свойства должно проявлять вещество для того, чтобы его можно было отнести к ароматическим соединениям? Ароматическими являются соединения с молекулярной формулой, указывающей на высокую степень ненасыщенности, которые, однако, не реагируют как ненасыщенные, а вступают в реакции электрофильного замещения с сохранением термодинамически устойчивой ароматической системы.
Условие ароматичности определяет правило Хюккеля .
Электронное и пространственное
строение бензола
10 класс (профильный уровень)
Цель. Cформировать понятие об ароматической связи, особенностях электронного строения и обусловленных ими химических свойствах бензола.
Задачи. Всесторонне рассмотреть строение бензола как наиболее важного представителя ароматических углеводородов; выяснить природу ароматичности.
Тип урока. Проблемная лекция.
Для того чтобы повысить мотивацию обучающихся для более успешного усвоения новой темы, можно заранее подготовить карточки с фамилиями учеников, перемешать их и объявить, что в конце урока нескольким школьникам из присутствующих достанутся вопросы, а вот кому, ребята узнают позже.
ХОД ЗАНЯТИЯ
Учитель. Как вы думаете, откуда произошло название «ароматические углеводороды»?
Первые представители класса ароматических углеводородов (аренов), выделенные из природных объектов, обладали своеобразным приятным запахом и получили название «ароматических». Однако сегодня в понятие «ароматический углеводород» вкладывают совсем другой смысл.
Урок целесообразно начать с рассмотрения химических свойств, сравнения и анализа полученных результатов и их обобщения.
Демонстрационные опыты
1) Горение бумаги, смоченной бензолом: указывает на возможную непредельность молекулы бензола, поскольку пламя коптящее, подобно пламени ацетилена.
2) Приливание бромной воды и раствора перманганата калия к бензолу: не подтверждает непредельный характер молекулы бензола.
Исходя из этого, обучающиеся приходят к выводу о специфичности химических свойств бензола, а следовательно, и строении молекулы.
Вопросы ученикам
1) Охарактеризуйте химические свойства бензола.
2) От чего зависят свойства вещества?
3) На что указывает коптящее пламя?
4) На что указывает отсутствие реакции с перманганатом калия и бромной водой?
Учитель записывает брутто-формулу бензола (С 6 Н 6) и предлагает составить возможные варианты структурных формул линейного и циклического строения.
Историческая справка
Может быть заранее подготовлена одним из обучающихся, а может быть сделана несколькими учениками в форме презентации.
В 1825 г. М.Фарадей выделил из светильного газа углеводород и исследовал его состав и свойства. Э.Митчерлих в 1835 г. нагреванием бензойной кислоты с негашеной известью получил углеводород, который оказался тождественным веществу, полученному Фарадеем. Митчерлих установил его формулу – С 6 Н 6 , Либих позднее назвал бензолом.
Особое внимание к этому углеводороду на протяжении уже более полутора столетий объясняется его специфическими свойствами.
Первая попытка объяснения таких свойств бензола была предпринята в 1865 г. А.Кекуле (рис. 1).
Наряду с формулой Кекуле были предложены и другие формулы бензола (рис. 2).
Учитель рассказывает о взаимодействии бензола с тремя молекулами водорода с образованием циклогексана и о получении бензола пропусканием ацетилена через нагретые до 500 °С стружки железа, отмечает, что структурная формула бензола должна соответствовать шестиугольнику с чередующимися двойными и одинарными связями.
Уравнения записываются на доске:
С 6 Н 6 + 3Н 2 -> С 6 Н 12 ,
3С 2 Н 2 -> С 6 Н 6 .
Далее учитель сообщает некоторые данные о циклическом строении бензола, акцентирует внимание на следующих моментах: на расположение всех атомов в одной плоскости и одинаковое расстояние между ядрами соседних атомов углерода. Благодаря открытию метода рентгеноструктурного анализа стало возможным объяснить строение молекулы бензола: при sp 2 -гибридизации из одной s -орбитали и двух p -орбиталей образуются три гибридные орбитали и остается одна негибридная р -орбиталь.
Гибридные орбитали образуют три -связи, а негибридные располагаются перпендикулярно плоскости и образуют единое -электронное облако.
Понятие об электронном строении бензола подкрепляется таблицами, моделями с диска «Электронный учебник. Открытая химия 2,5»; объемными моделями с диска «Учебное электронное издание. Виртуальная лаборатория. Химия. 8–11 классы».
Учитель. Давайте подумаем, если в молекуле присутствует -связь, то почему же не происходят характерные для алкенов реакции (присоединение брома и окисление перманганатом калия)?
О т в е т. Сочетание шести -связей с единой -электронной системой называется ароматической связью. Электронная плотность распределена равномерно. Следовательно, в молекуле бензола нет ни простых, ни двойных связей. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные для бензола свойства. Цикл из шести атомов углерода, связанных шестью -cвязями и единым -электронным облаком, называют бензольным кольцом или бензольным ядром.
Физические методы исследования показали следующее (см. таблицу).
Таблица
Строение молекулы бензола
Напоминаю, что валентный угол 120 ° соответствует sp 2 -гибридизации атомов углерода.
Итак, давайте подведем итог изучения строения молекулы бензола.
Здесь можно воспользоваться заготовленными карточками с фамилиями, а можно попробовать задать вопрос по адресу. Заранее на подготовленных карточках пишется адрес, например: «улица 1, дом 3, квартира 1», где улица – номер ряда, дом – номер парты, квартира – вариант. Вытаскивается карточка, определяется ученик, «живущий» по этому адресу, и ему задается вопрос, затем вытаскивается следующая карточка.
Примеры вопросов
1) Какова формула молекулы бензола?
2) Какой тип гибридизации у атомов углерода в этой молекуле?
3) Что такое ароматичность?
4) Как влияет строение молекулы на свойства вещества?
5) В каком году и кем был впервые получен бензол?